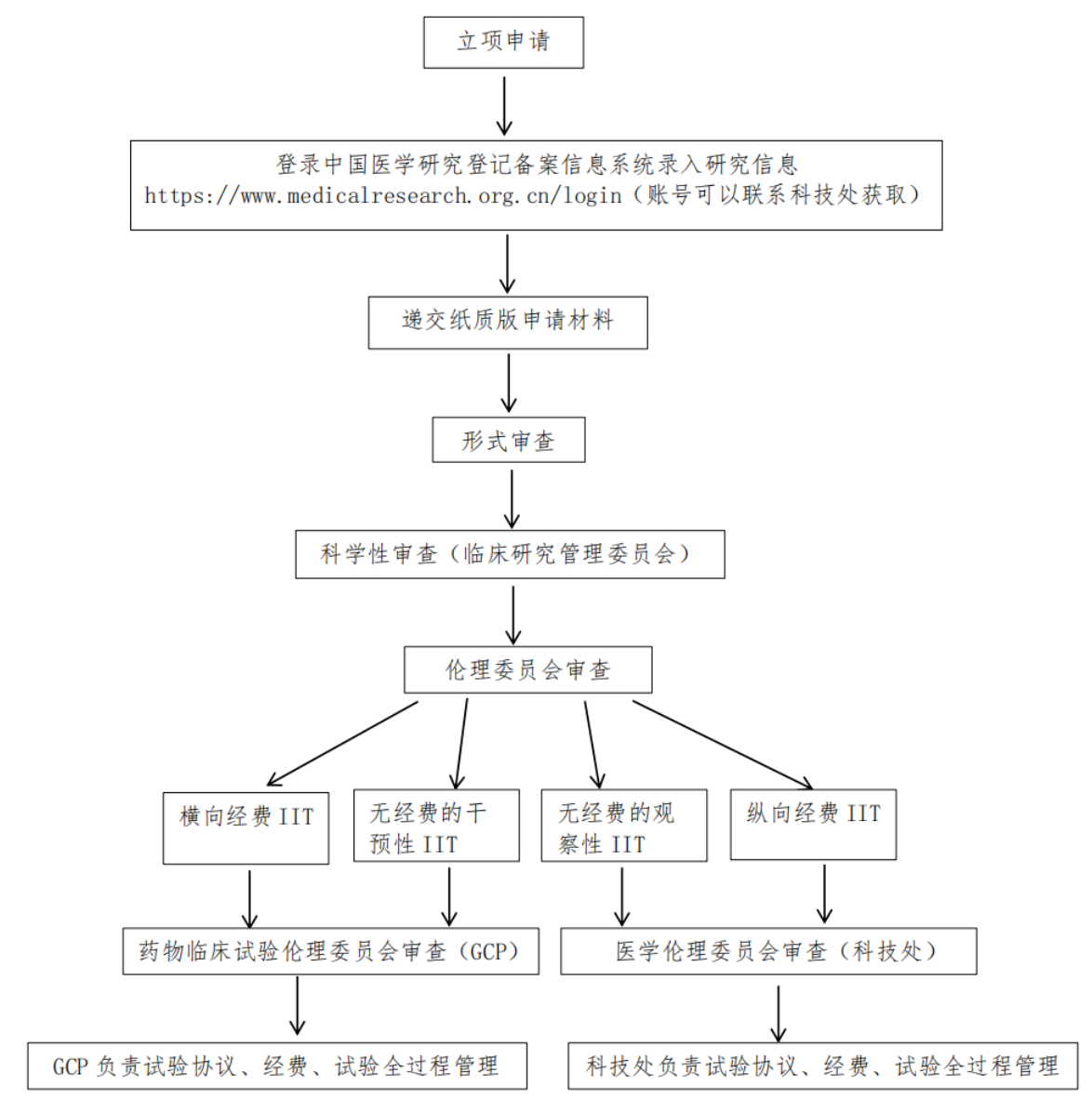
图1 江南大学附属医院研究者发起的临床研究(IIT)开展流程
(一)申请临床研究管理委员会审查或备案
1.申请审查
申请者(主要研究者)按照附件 2 的要求,将必须的纸质/电子资料交临床研究管理委员会申请立项审查。临床研究管理委员会根据相应的制度和流程,对研究者提出的申请进行学术性审查和决策,必要时应进行机构外专家匿名评审后,及时反馈审查结果。确无资金支持的,应填写附件 7 的《临床试验项目无任何经费资助声明》。
适用的研究类型:本院作为牵头单位(或单中心),有横向经费支持的研究者发起的临床研究(Investigator Initiated Trials,IIT);本院作为参与单位,有横向经费支持的 IIT,但牵头单位为一般地市级三甲医院的,或由市级以及以下学会、协会发起的;无经费资助的自发 IIT。
2.申请备案
申请者(主要研究者)按照附件2 的要求,将必须的纸质/电子资料递交临床研究管理委员会申请立项备案。临床研究管理委员会根据相应的制度和流程,快速审查申请人递交的材料,材料符合备案要求的,则予以备案。
适用的研究类型:本院作为参与单位,有横向经费支持的 IIT,且牵头单位为大学医学院附属的三级甲等以上医院或由省级以上学会、协会发起的;纵向经费支持的临床研究课题(基金项目或指令性项目);本院牵头的(或单中心)药物生物等效性研究。
(二)试验立项
1. 通过药物临床试验机构立项管理
临床研究管理委员会审查通过/完成备案后,根据药物临床试验机构立项操作流程,申请者(主要研究者)或受委托的医药研发合同外包服务组织(Contract Research Organization,CRO)人员,在机构的临床试验管理信息系统进行项目的立项申请,并同时按照系统要求递交项目资料(电子版)。机构办工作人员核对资料和临床研究管理委员会的审查决定文件无误,即可予以立项通过并分配系统项目编号,并将立项信息提交到伦理审查信息系统。申请人即可将申请资料的纸质版按照要求递交给药物临床试验伦理委员会。
适用的研究类型:有横向经费支持的 IIT。
2. 通过科技处立项管理
申请者(主要研究者)向科技处申请获取国家医学研究登记备案信息系统的电子账号系统录入研究信息进行备案,经医院临床研究管理委员会审查通过/完成备案后。按照附件 2 表格中的要求,将立项申请资料以及临床研究管理委员会的审查决定一同递交科技处项目管理人员,按照科技处的科研项目管理制度进行立项管理。
适用的研究类型:纵向经费支持的临床研究课题(基金项目或指令性项目);无经费资助的自发 IIT。
(三)伦理审查
1. 药物 / 医疗器械临床试验伦理委员会
伦理委员会秘书接收到试验管理系统的立项信息推送,并接收到申请人递交的纸质资料后,根据伦理审查的标准作业程序 (Standard Operation Procedure,SOP),提交会议 / 快速审查或予以备案,并根据审查意见及时反馈对该研究的审查 / 备案结果。 伦理委员会将对研究进行跟踪审查,申请人(主要研究者)应按照伦理委员会要求,按时、及时递交项目进行的阶段性报告。
适用的研究类型:有横向经费支持的 IIT 。
2. 医院医学伦理委员会
医学伦理委员会对接人员接收到申请人递交伦理审查申请表(附件 6 )、科研立项文件以及其他纸质资料后,根据医学伦 理审查的SOP ,提交会议 / 快速审查或予以备案,并根据审查意 见及时反馈对该研究的审查 / 备案结果。医学伦理委员会将按照相关SOP对科研立项的临床研究进行跟踪管理。
适用的研究类型:纵向经费支持的临床研究课题(基金项目或指令性项目);无经费资助的自发 IIT 。
(四)试验协议及经费管理
1. 药物临床试验机构管理
取得伦理批件 / 备案后,资助方、机构办公室和主要研究者拟订合同,按照药物 / 器械临床试验项目管理流程处理。资助方按照合同约定将试验经费汇入医院财务指定的账户,并按照医院制定的药物和医疗器械临床试验经费管理流程进行管理。
适用的研究类型:有横向经费支持的 IIT 。
2. 科技处管理
取得伦理批件 / 备案后,申请人与科技处确认,并按照科技 处的项目管理流程处理。其基金或资助经费、配套经费,按照科研经费管理制度严格管理。
适用的研究类型:纵向经费支持的临床研究课题(基金项目 或指令性项目);无经费资助的自发 IIT 。
(五)研究实施全过程的管理
项目启动前,必须完成所有必须的监管部门的审批或备案,包括但不限于根据《中华人民共和国人类遗传资源管理条例》获取科技部人类遗传资源管理办公室的审批或备案(如适用)、进 行信息对外提供 / 公开的备份备案(如适用)等。
1. 药物临床试验机构管理
机构办公室确认资助方已按照合同打款,并接收到试验启动 物资,包括试验文件、试验药物、试验器械等后,按照相关 SOP 预约进行项目启动并实施。机构 / 专业组质控员视具体情况对试验项目质量进行监督管理,对存在的问题提出书面整改意见,研究者予以整改并给予书面答复。试验药物、医疗器械按照药物临 床试验机构的相关SOP 管理。在研究过程中,研究者需要对临床研究项目进行变更的,应当根据本次拟修改的内容,再次向医院临床研究管理委员会申请学术性审查或申请备案。医院临床研究管理委员会审查 / 备案通过后,再向伦理委员会提出修改的审 查申请 / 备案申请,伦理委员会则按规定进行审查或给予备案。必须在获得医院临床研究管理委员会、伦理委员会的审查批准或备案后,方可按照修改后的内容继续研究。申请人可根据机构和伦理委员会的SOP申请暂停或终止研究。试验结束,机构办与资助方按照合同结清尾款,在分中心小结或总结报告上盖章后, 递交伦理委员会申请结题。按照医院的药物、医疗器械临床试验 经费管理制度,机构办公室对试验经费进行结算,按财务流程审 批后由主要研究者进行相关劳务费发放(如适用)。按照药物临 床试验机构的试验资料管理制度、SOP 和试验合同的单独约定, 对试验相关资料进行存档管理。
适用的研究类型:有横向经费支持的 IIT 。
2. 科技处管理
根据科技处项目经费使用管理制度和相关部门的规定,对科研立项的项目的立项、运行、结题等运行全过程进行管理和监督。 在研究过程中,研究者需要对已立项的临床研究项目进行变更的,应当向科技处报告。科技处应当评估本次拟修改的内容,对涉及研究目的、研究方法、统计方法以及研究对象等实质修改的,应当要求申请者再次提交医院临床研究管理委员会和 / 或医学伦理委员会重新进行科学性和伦理审查。如有必要,还应向该研究项目的纵向监管部门报告。申请人可根据科技处的项目管理规定申请暂停或终止研究。
由申请人(主要研究者或项目负责人)按照科技处有关资料存档、管理的规定,负责试验资料的存档,应保证试验数据的可溯源、试验资料在规定年限内的安全存放。
适用的研究类型:纵向经费支持的临床研究课题(基金项目或指令性项目);无经费资助的自发 IIT 。